2021年11月5号,澳门威斯人0168核药学系/江苏省原子医学研究所创新药物研究中心林建国教授和邱玲教授的团队在国际著名学术期刊《ACS Nano》(IF=15.881)上在线发表了题为“Tumor Microenvironment Responsive "Head-to-Foot" Self-Assembly Nanoplatform for Positron Emission Tomography Imaging in Living Subjects”的研究论文,报道了一种肿瘤微环境响应激活型智能小分子PET探针,成功实现了探针放射性信号较长时间滞留在特定的靶组织中,达到了高特异性、高灵敏度的PET显像效果,为发展新一代核素靶向诊疗分子探针提供了新的策略。

生物素受体在多种肿瘤细胞中过表达,是肿瘤诊断和治疗研究中一个重要靶点。研究人员基于2-氰基苯并噻唑与半胱氨酸(CBT-Cys)的点击缩合反应,在肿瘤微环境中通过还原、缩合进行分子间环化,并进一步通过原位自组装策略进行纳米聚集,从而增强探针在肿瘤部位的滞留效果。该探针的作用机制从理论到实验、从体外到体内得到了充分验证。
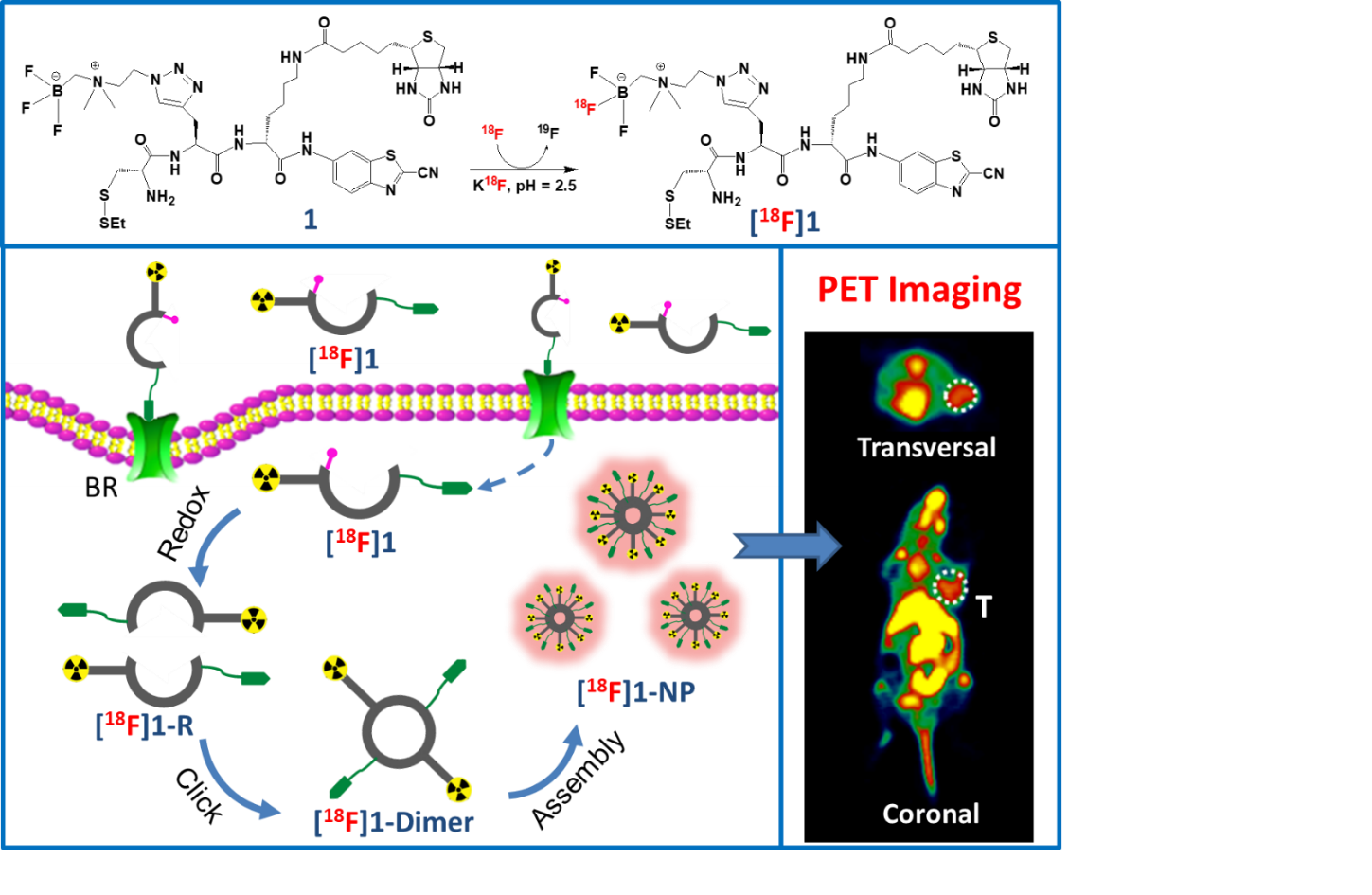
分子探针的结构及作用示意图
在生物素受体过表达的肺癌A549和宫颈癌Hela动物模型中,分子探针[18F]1给药15分钟后即可获得高靶本比的PET图像,60 min时肿瘤/肌肉靶本比仍大于4;而在生物素受体低表达的结肠癌HCT116荷瘤鼠中,探针[18F]1对肿瘤几乎无显像能力,说明该分子探针具有良好的特异性。对于缺失生物素靶向基团或没有还原自组装功能的对照探针[18F]1a和[18F]1b,难以在生物受体过表达的肿瘤中进行富集,说明肿瘤靶向和自组装协同策略可有效提高PET分子探针的显像效果。该策略对设计发展新一代核素靶向诊疗药物具有重要的参考价值。
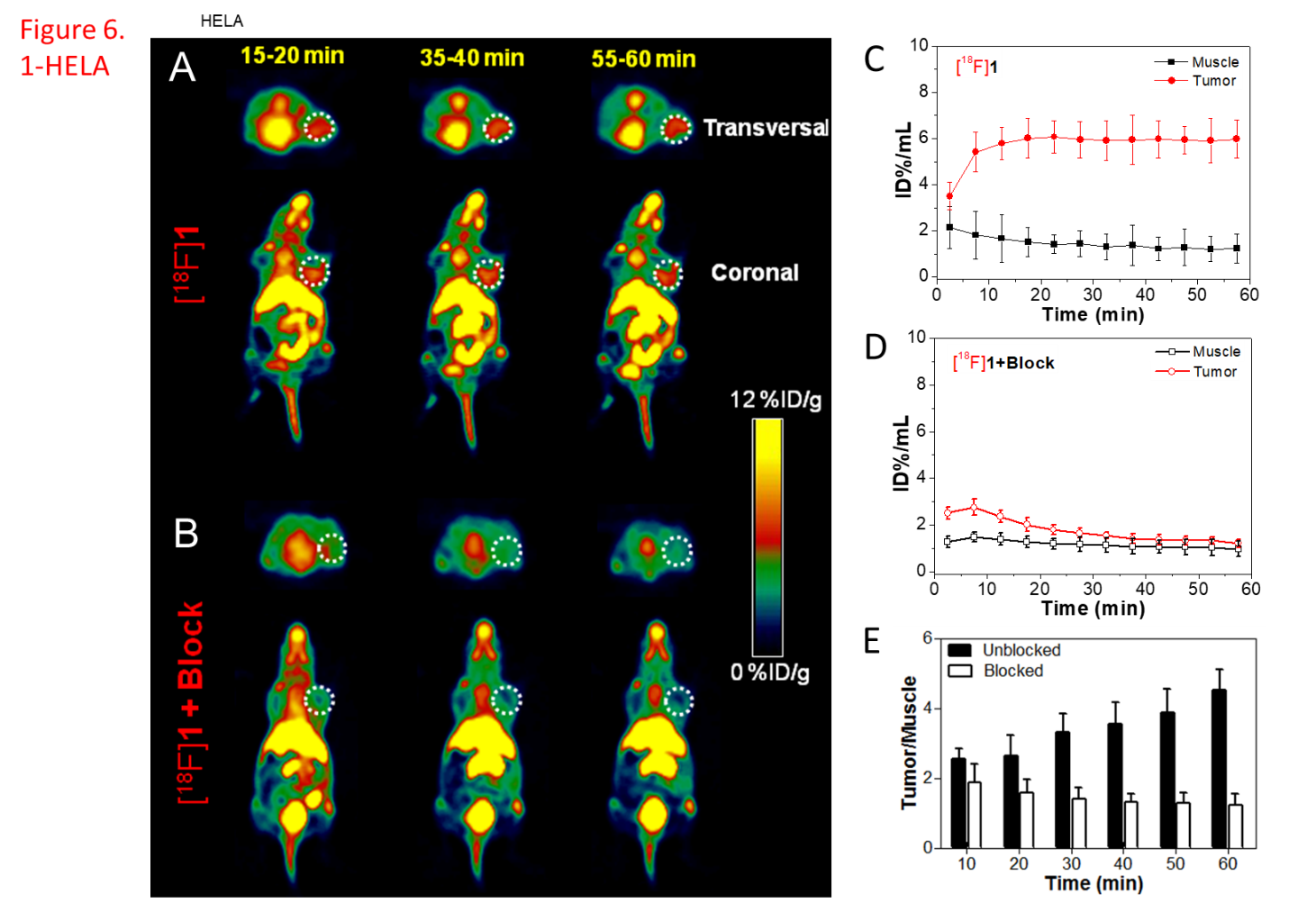
生物素受体过表达肿瘤模型PET成像结果
我院核药学系邱玲教授和林建国教授分别是论文的第一作者和共同通讯作者。该研究得到国家自然科学基金和江苏省自然科学基金的资助。
(图文/邱玲、林建国;审核/陈宏山)


